台灣風險分析學會
Taiwan Society for Risk Analysis

2021年第4期
淺談美國環保署對環境內分泌干擾物和人類健康的觀點(上篇)
農業藥物毒物試驗所 呂水淵
Release: Apr 05, 2021
摘要
本文的目的在提供內分泌干擾物化學(endocrine disrupting chemical, EDC)研究領域及其與人體健康的關係的觀點。研究過去四十年來在監管機構中經由雄性素(androgen, A)或雌性素(estrogen, E)訊息傳導途徑發揮作用的EDC的作用,目的是提供風險評估者可用來減少風險評估中不確定性的數據。自1990年代以來,研究學者貢獻在體外和體內數據為監管機構的決策(https://www3.epa.gov/殺蟲劑/chem_search/cleared_reviews/csr_PC-113201_7-Apr-98_238.pdf)。從一開始,學者們就評估體外和短期體內效應對預測發育中動物的危害反應的效用[1; 2]。這種方法已經大大擴展,包括現在所謂的危害作用途徑(adverse outcome pathway, AOP)和網絡(AOP network, AOPn)[3; 4]。AOP框架對雄大鼠的性別分化過程中,對破壞雄性素訊息的化學物質的作用提供生物學背景,可用於從囓齒類動物的體內和體外測定中,將機制訊息外推到包括人類在內的其他物種,這種方法具有生物學有效性,因為E和A途徑在包括人和實驗動物在內的脊椎動物中高度保守。
關鍵詞
危害作用途徑和網絡(Adverse Outcome Pathways and Networks); 內分泌干擾物和人類健康(Endocrine disrupters and human health); 內分泌干擾篩選與測試(EDC screening and testing); 劑量反應(Dose response)
一、前言
針對EDC作用,在生命階段和組織特異性AOP的開發可以減少將EDC的影響,從實驗室動物的體外和體內研究推算給人類的不確定性。當路徑中的關鍵事件(key events, KEs)和分子啟動事件(molecule initiating events, MIEs)在物種之間高度保守時,如雄性素(A)和雌性素(E)信號通路的情況,則更有可能確定該途徑的破壞將對物種產生不利的影響。例如,雄性素受體拮抗劑氟他胺或雄性素促進劑醋酸去甲雄三烯醇酮(trenbolone)[5]等(抗)雄性素化學物質會在脊椎動物中產生生殖系統的物種典型改變[6],因為雄性素受體(AR)途徑從魚類到人類的高度保守。學者們正在開發一個包含多個「雄性素」的AOP網絡,因為單個AOP不能捕獲有助於破壞雄大鼠性別分化(危害作用途徑(AOP)的所有分子引發事件(MIE)和關鍵事件(KE)))(圖1)[7]。雖然某些AOP共享公共下游事件(KE),但其他AOP不共享。學者的目標是開發能夠量化每個AOP中MIE和KE的測定方法,並確定達到下一步所需的擾動程度,從而使我們能夠以合理且準確性預測對雄性產生不利生殖影響的各種化學物質和混合物的劑量水平在性分化過程中接觸後的大鼠後代。目前,學者們能夠經由抑制胎兒睾丸激素的合成來預測產生F1雄大鼠生殖道異常的劑量[7]。學者還嘗試量化可預測“抗雄性素” AOPn中其他AOP的KE。破壞E和A途徑的化學物質的初步鑑定取決於有效的體外和短期體內篩選試驗的執行和解釋。下面提供一些有關EDC領域的背景以及某些篩選方法的價值和局限性。此外,學者們發現,與體外MIE評估相比,下游KEs(例如胎兒睾丸激素的產生或雄性素依賴性組織生長的抑制)分別是子宮內鄰苯二甲酸酯(phthalate)暴露或AR拮抗劑暴露危害後果的更好預測指標。與體內AR結合和體外基因表達的測定相比,AR拮抗劑在子宮內的危害反應與體內AR篩選測定的影響之間存在更強的定量關係。
二、內分泌干擾物背景說明
從1991年開始,由西奧多科爾伯恩(Theo Colborn)組織的一系列研討會定義了「內分泌干擾物」 一詞,並就EDC對人類和生態系統健康的影響發表了共識性聲明[8]。由於擔心EDC的潛在影響,1996年通過了《食品質量保護和安全飲用水法案》,該法案授權EPA建立雌性素和其他物質的篩選計畫,並於1998年通過內分泌干擾物篩選和檢測諮詢委員會(EDSTAC) 向EPA提出EDC篩選和測試策略。對該方法進行評估,分析驗證並於2004年發布以供審查。2009年,EPA宣布篩選組合的可用性(詳細時間表(https://www.epa.gov/sites/production/files/2016-04 / documents / edsp-timeline-042016.pdf)。
三、內分泌干擾篩選計畫第一階篩選組合(Endocrine Disruptor Screening Program Tier 1 Screening battery, EDSP T1S)
EDSP T1S包含11種體外和短期體內測定法,以篩選具雌性素(E)、(抗)雄性素(A)或(抗)甲狀腺(thyroid, T)(EAT)活性或抑制下丘腦-垂體-性腺軸能力與雌性素、雄性素、及甲狀腺素有關的化學物質。(https://www.epa.gov/test-guidelines-pesticides-and-toxic-substances/series-890-endocrine-interruptor-screening-program)。有報導指出,現有組合未能檢測到某些化學物質的EAT活性、尚未得確效、並且尚未開發出「更好」經過驗證(穩健與再現性)的短期檢測方法。可以使用最新的重組蛋白[9]來改進、替換或增強當前組合中的體外測定,以評估受體結合和可以將促進劑與拮抗劑區分開的新的基於細胞的測定[10; 11; 12]。這將減少動物的使用並提高數據質量。由於體外試驗的當前局限性,所以包括體內短期試驗。體外測定目前缺乏吸收(absorption, A)、分佈(distribution, D)、代謝(metabolism, M)和排泄(excretion, E)(ADME),它們無法說明組織和物種的特異性作用,對於所有危害作用途徑(例如鄰苯二甲酸鹽),MIE尚不為人所知,而且很大比例化合物不適合進行體外測試[13]。由於這些限制,我們無法在Hershberger分析(HA)或暴露於子宮內的雄性後代中預測抗雄性素化學物質的體內作用。相反,HA結果確實使我們能夠預測破壞子宮內雄性生殖發育的AR拮抗劑的劑量[14]。當體外ER和AR數據來自高通量分析(high through-put assays, HTS)時,還需要考慮樣品的純度(迄今為止評估的Tox21樣品中約25%的佔比其純度低於90%,約8%的佔比其純度更低,低於5%的純度),並且某些檢測方法可能未進行優化,HTS數據可能顯示出較大的檢測間和檢測內變異性[15]。此外,列出了一些不太可能的化學藥品,帶有「有效的」雌性素受體-曲線下面積(estrogen receptor area under curve, ER AUC)模型評分(定義為AUC> 0.1),包括去甲雄三烯醇酮(trenbolone)(AUC = 0.475),二氫睾丸酮(dihydrotestosterone)(AUC = 0.4),丙酸睾丸酮(testosterone propionate)(AUC = 0.392),丙基硫尿嘧啶(propylthiouracil)(AUC = 0.144),三碘甲腺氨酸(triiodothyronine)(AUC = 0.135)(https://www.epa.gov/endocrine-disruption/endocrine-disruptor-screening-program-edsp-estrogen-receptor-bioactivity)。通常,E和A體外測定法的陽性預測率似乎低於陰性預測率(假陽性率比假陰性率高)。此外,當多個MIE在體外受到影響時,無法預測其中哪個會在體內驅動毒性[14]
四、內分泌干擾篩選計畫第一階篩選組合結果
自從2007年提出首個要篩選的化學物質清單,並於2009年發布了最終的T1S測試指南以來,已經使用T1S組合對52種化學物質進行篩選。(https://www.epa.gov/endocrine-disruption/endocrine-disruptor-screening-program-timeline)。這些都沒有顯示出雌性素活性,而有兩種是抗雄性素的(https://www.epa.gov/endocrine-disruption/endocrine-disruptor-screening-program-tier-1-screening-measures-and)。T1S的執行比預期的要耗費更多的資源,並且勝任的實驗室很難滿足《測試指南》[17]中描述的某些性能標準。主要問題來自於體內測定的劑量設定。明顯的毒性混淆了EDC活性的識別,並且某些測試準則包含錯誤的性能標準。基於對已發表文獻的評估,學者[4; 18; 19]建議將11種T1S分析與第一層中的兩個「看門(gatekeeper)」分析進行分層。如果這兩種測定均為陰性,則不會進行其他篩查。但是,尚未對這一概念進行嚴格的實驗評估(圖2)。總而言之,考慮到自2009年以來的進展速度和執行T1S所需的資源,目前尚不確定在短期內將有多少有用的數據可用於危害識別和風險評估。
五、內分泌干擾研究未解議題
目前,對EDC和其他科學領域的研究陷入了許多領域的爭論,並且不清楚科學和法規如何以建設性方式前進,而沒有不同的團體開始以建設性的方式討論這些觀點分歧。很多內分泌干擾研究缺少可重複性,科學界最近將重點放在重要研究觀察結果的可重複性問題上,包括對EDC的研究。人們越來越意識到,不能複制許多引人注目的研究的結果。在Science Exchange、PLOS、Figshare和Mendeley之間的協作下,發起了一項可複制性倡議,以鼓勵期刊為作者和同行審閱者建立指導,以確保研究的正確執行和適當的同行審閱。出版物的方法中應有強制性的報告要求,以確保:1)對多代和跨世代研究進行正確的實驗設計,2)對不同世代的窩為基礎的影響和血統影響進行適當的統計分析,以及3)對化學物質來源進行適當的記錄和報告、批次、純度和CAS號碼。最後,科學家應該客觀地檢驗假設,而不是試圖證明它們,並且在解釋結果時必須具有客觀性,並且不能誇大發現的意義。
六、低劑量暴露
用語「低劑量」具有幾個不同的定義。在某些情況下,科學家指的是EDC的「與環境有關」的水平。但是,並非所有的「環境」EDC都較低[20; 21; 22; 23; 24]。在其他情況下,科學家指的是實驗中使用的最低劑量或低於無可見毒害作用劑量(no observed adverse effect level, NOAEL)、參考劑量(reference dose, RfD)或可接受的每日攝入量(acceptable daily intake, ADI)的劑量。「低劑量」是一個有用的描述性用語,但作者需要定義其在出版物或演示文稿中的使用方式。
七、低劑量之劑量反應曲線型態 (線性、閾值或非單調劑量反應)
自1940年代後期以來,就一直在爭論低劑量區域的劑量反應曲線的形狀[25]。辯論最初集中在低劑量範圍內的線性無閾值(linear-no-threshold, LNT)與閾值反應(threshold responses)之間,以引起癌症和非癌相關的影響。儘管通常認為EDC和其他非癌效應顯示出危害反應閾值,但由於經驗告訴我們在非常低的EDC劑量需要無限大的樣本量,因此無法憑經驗解決低劑量區域(線性與閾值)的劑量反應曲線的形狀以決定與對照組反應比較的統計學顯著差異(OECD,2012; ENV / JM / MONO(2011)47)。在2009年EPA資助的研討會上[25],大多數參與者得出結論,對於人群水平的風險分析,在沒有基於作用模式(MOA)的劑量反應模型的情況下,對於兩種癌症最合適的低劑量外推方法非癌症終點是線性的,從觀察到的反應範圍內無閾值外推,從而認知到人口變異性以及背景疾病和暴露對劑量-反應關係的影響。此外,雖然統計上確定沒有觀察到的危害作用劑量(NOAEL)可用於化學危險性評估,但在這些值以下可能會發生分子相互作用,因此,NOAEL不是「真正的」 NOAEL。例如,我們發現將每種化學物質的NOAEL之下的15到20種化學物質合併在一起,所有雄性後代都表現出生殖道畸形[26]。
有人提出,EDC是一類特殊的毒物,經常表現出「低劑量」非單調劑量反應(non-montonic dose response, NMDR)關係[27],這混淆了NOAEL的鑑定和最低的觀察到的危害作用劑量(lowest-observed-adverse-effect level, LOAEL)。儘管針對這個問題進行的穩健的多代劑量反應研究通常是負面的,但教條在一些EDC圈子中被廣泛使用[28]。E和A活性化學品的明顯之處在於由於荷爾蒙受體在體內的廣泛表達,它們可以同時誘導不利和有益的作用,而且暴露的後果在不同的生命階段、性別和組織之間也存在很大差異。顯然,E和A活性化學品的所有作用都不會不利,因為其中某些作用是非常有益的。
NMDRs常在體外觀察到,但通常以高濃度而不是低濃度發生,並且通常是由細胞毒性引起的[29]。雖然不常見,但有大量的NMDR對脊椎動物產生危害影響的例子(例如[30; 31; 32; 33])(圖3)。但是,幾乎沒有令人信服的證據表明,當發現生物學上合理的NMDR時,這些影響是不利的,低劑量的影響,這會改變EDC的風險評估[34]。 NMDR問題已由USEPA審查過,目前正由NAS審查(http://dels.nas.edu/Study-In-Progress/Unraveling-Dose-Toxicity- Case-Studies / DELS-BEST-14- 07)。
儘管有相當數量的關於雌性素、類固醇合成抑製劑和抗雄性素的穩健的多代研究,其中包括從低劑量到高劑量的廣泛劑量水平,但其他EDC的作用方式尚未得到充分研究。此外,體內EDC篩選研究中有關劑量反應曲線形狀的訊息較少。值得注意的是,在21天的黑頭呆魚(fathead minnow)繁殖試驗中,生物學反應隨時間發生了顯著的時間變化[35]。學者回顧有關經由雄性素(A)和雌性素(E)訊息通路破壞生殖發育和功能的化學物質的案例研究中有關LNT、閾值和NMDR反應的文獻[36],並得出以下結論(https:// www.epa.gov/sites/production/files/2016-01/documents/nmdr.pdf)[37; 38]。內分泌干擾劑量反應結論,NMDR曲線在生物學上看似合理,並經常在體外測試出現,但通常在體內測試不相關的高濃度下出現[39]。在體內引起一些似乎是LNT的反應(圖3)。NMDR曲線在短期和長期暴露中更為常見,上游、機制事件與下游不利影響有關[35]。對於相同的EDC(例如,長春新鹼[40]),不同的組織可能表現出不同的劑量相關反應(LNT與閾值)。當EDC的不利影響是非單調的時,其他影響通常在較低的劑量水平下顯示出單調的反應。劑量反應曲線的形狀可能受多種因素影響,包括生命階段、暴露途徑、目標組織和EDC途徑或ADME中的物種差異。已進行許多強有力的雌性素和抗雄性素的多代研究,低劑量時NMDR曲線並不常見。可以逐案增強多代測試指南,以提高對某些EDC的低劑量效應的敏感性。
八、內分泌干擾測試
(一)生殖測試指引
對EDC的全面測試需要完整的生命週期評估。檢查雄大鼠生育力的研究要求暴露的精子至少含蓋整個精子形成的整個週期,而一項不包括將F1交配以產生F2代的單代研究未能評估F1在交配行為方面的幾種潛在發育變化, 排卵、著床、維持妊娠、分娩、哺乳和母親行為。在這方面,國家毒理學計畫開發一種新的研究設計,稱為改良一代(modified one generation, MOG)生殖研究,其中包括對發育和生殖毒性的測定。暴露是在妊娠期間開始的,重點是F1動物,而MOG具有足夠的能力來檢測F1中的較低劑量反應[41]。
(二)對檢測低劑量反應的統計力
許多出版文獻已證明,多代和體內EDC篩選測試中使用的當前樣本量缺乏足夠的統計能力來檢定低發生率的危害反應(即p <0.05)[42; 43; 44]。例如,Blystone等人(2010年)[44]報導,在鄰苯二甲酸二乙基己酯(diethylhexyl phthalate, DEHP)的多代研究中,檢查所有雄性而不是每窩一隻雄性,可以將NOAEL降低一個數量級。
(三)標準測試指南中的評估指標是否足以檢測毒害的低劑量效應
儘管最近對多代和一代測試的更改提高了這些測試指南檢測AR拮抗劑的某些低劑量反應的能力,但對具有其他作用方式的EDC的研究可能包括其他終點,以增強檢測低劑量的能力效果。例如,雄大鼠的乳腺組織增生係由某些具雌性素作用之化學物質所誘發,其劑量水平低於目前方案中的評估指標[45]。另外,雄性素對子宮內雄性素對女性生殖道的更敏感作用,包括保留雄性副性腺組織[46],以及抗甲狀腺化學物質的發育作用,通常不會在多代方案中進行評估。
九、各種化學品的混合效應,以及將最好的現有科學方法納入風險評估中
儘管已經對EDC混合物的影響進行廣泛的討論,並且已經達成廣泛的共識,即不管作用機制如何,影響共同標的器官的EDC通常以劑量加成的方式起作用,但是並沒有大量的調節作用。 在這個問題上, 顯然,每個人都有獨特的化學物暴露特徵,這些化學物經由多種作用方式引起作用,但尚不清楚這些暴露是否有問題。
十、結論
適用於EDC的定量AOPns,研究人員或研究團隊必須將21世紀的體外和分子工具與20世紀的生物學(包括毒理學、內分泌學、實驗設計、統計學、組織學、解剖學、生理學和生物化學)相結合。在缺乏全面生物學視角的情況下,體外數據集的計算毒理學可能會導致AOP中一些相當不現實的MIE、KE和AO關聯以及生物學上難以置信的預測。要成功開發出本文介紹了學者對EDC領域的看法。上面所表達的關注和爭議在該研究領域中絕不是唯一的,並且在任何情況下都不會剝奪該研究成為毒理學風險評估的前沿的巨大潛力。AOPs的研究和AOPns的開發提供了一個框架,用於將細胞和分子MIE和關鍵事件納入到可以定量量化方式與特定危害生殖結局相關聯的途徑中,並有助於將EDC篩選和測試研究的影響外推至人類。
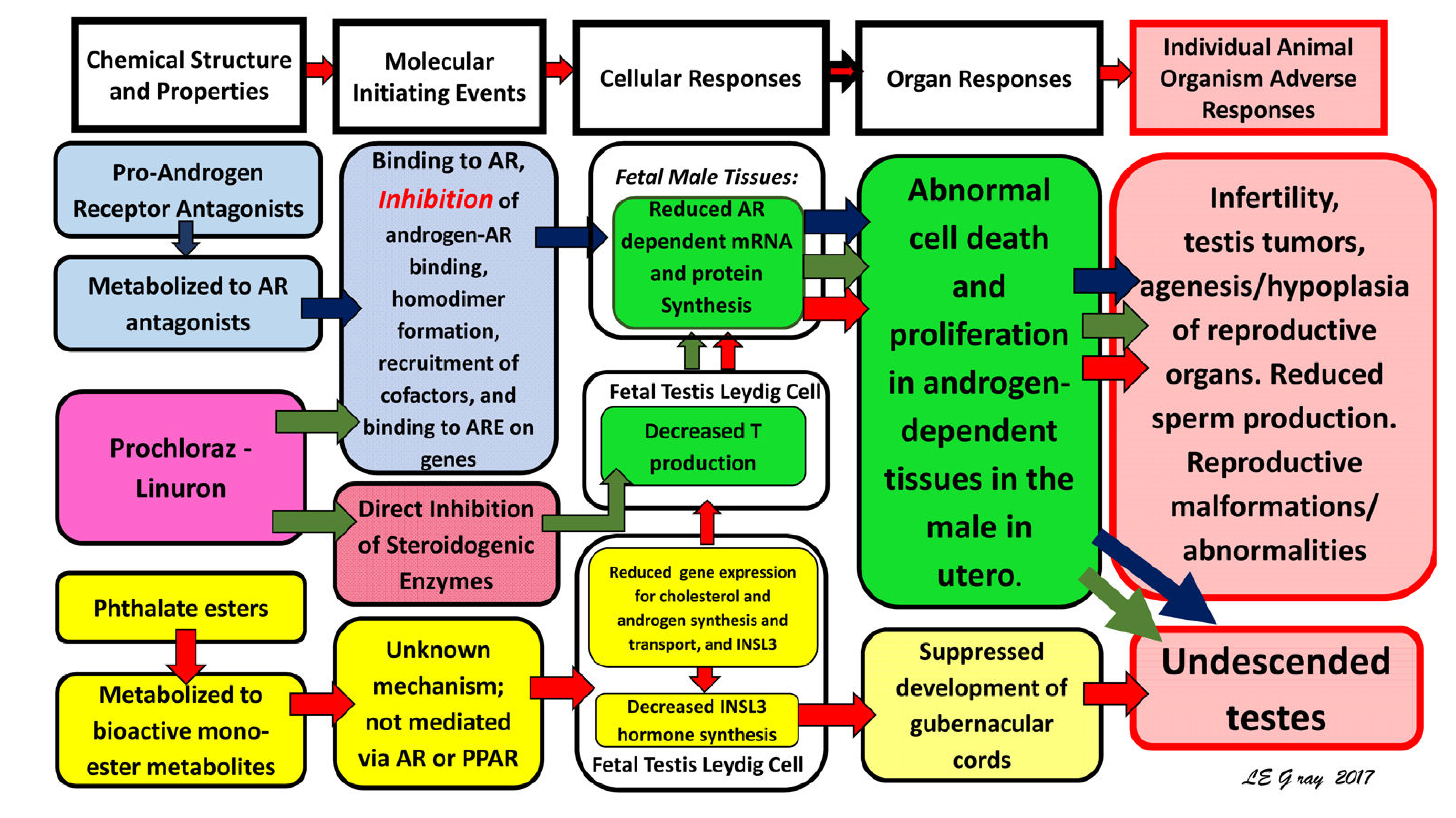
圖1.抗雄性素AOP網絡(圖內容摘要),雄大鼠中雄性素和胰島素樣激素3(insulin-like hormone 3, INSL3)依賴的生殖發育受阻的危害結局途徑網絡。AOP網絡的第一列確定了三類已知可通過三種不同的作用機制破壞雄性素信號通路的化學物質。不同顏色的箭頭表示每種化學物質發揮作用的途徑:藍色箭頭,雄性素受體(AR拮抗劑);綠色箭頭,化學作用的雙重機理(AR拮抗劑和類固醇酶抑製劑);紅色箭頭和鄰苯二甲酸鹽(分子引發事件未知,但已知會抑制胎兒睾丸激素(testosterone, T)的產生)[7]。縮寫:AR-雄性素受體; 靶基因上的雄性素受體反應元件; mRNA-信使核糖核酸[48]。